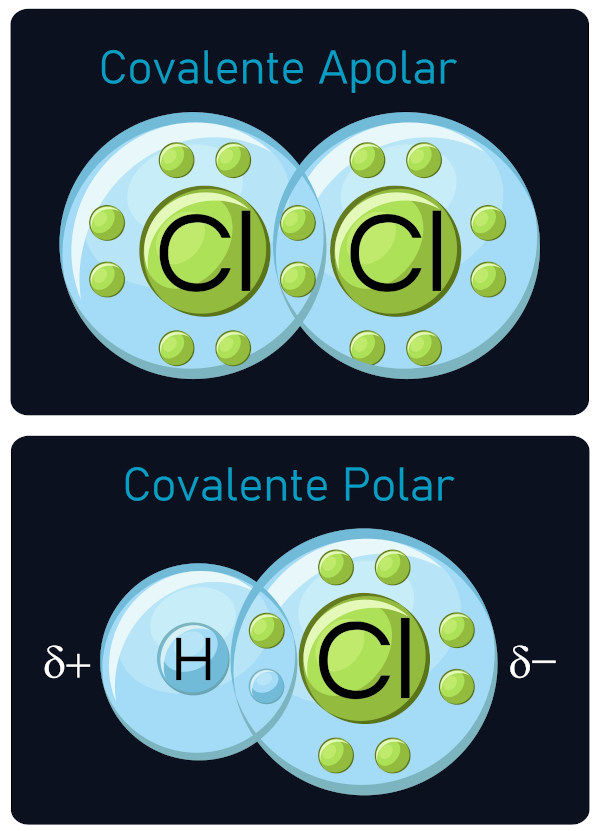
1. Otra molécula no polar que se muestra a continuación es trifluoruro de boro, BF 3. BF 3 es una molécula plana trigonal y los tres átomos periféricos son iguales. Figura 4.12.1 4.12. 1 Algunos ejemplos de moléculas no polares basadas en geometría molecular (BF 3 y CCl 4 ). Las moléculas polares son asimétricas, ya sea conteniendo.. Un enlace covalente no polar (Figura 4.9.1a 4.9. 1 a) es aquel en el que los electrones se comparten por igual entre dos átomos. Un enlace covalente polar (Figura 4.9.1b 4.9. 1 b) es aquel en el que un átomo tiene una mayor atracción por los electrones que el otro átomo. Si la atracción relativa de un átomo por electrones es lo.
/PolarConvalentBond-58a715be3df78c345b77b57d.jpg)
Definición y ejemplos de un enlace polar en Química

CLUSTER divulgación científica Polar y apolar
Caracteristicas De Enlace Covalente Polar prodesma
DIFERENCIAS entre covalente polar y no polar YouTube

Tipos de enlaces quimicos. metalico, ionico, covalente YouTube
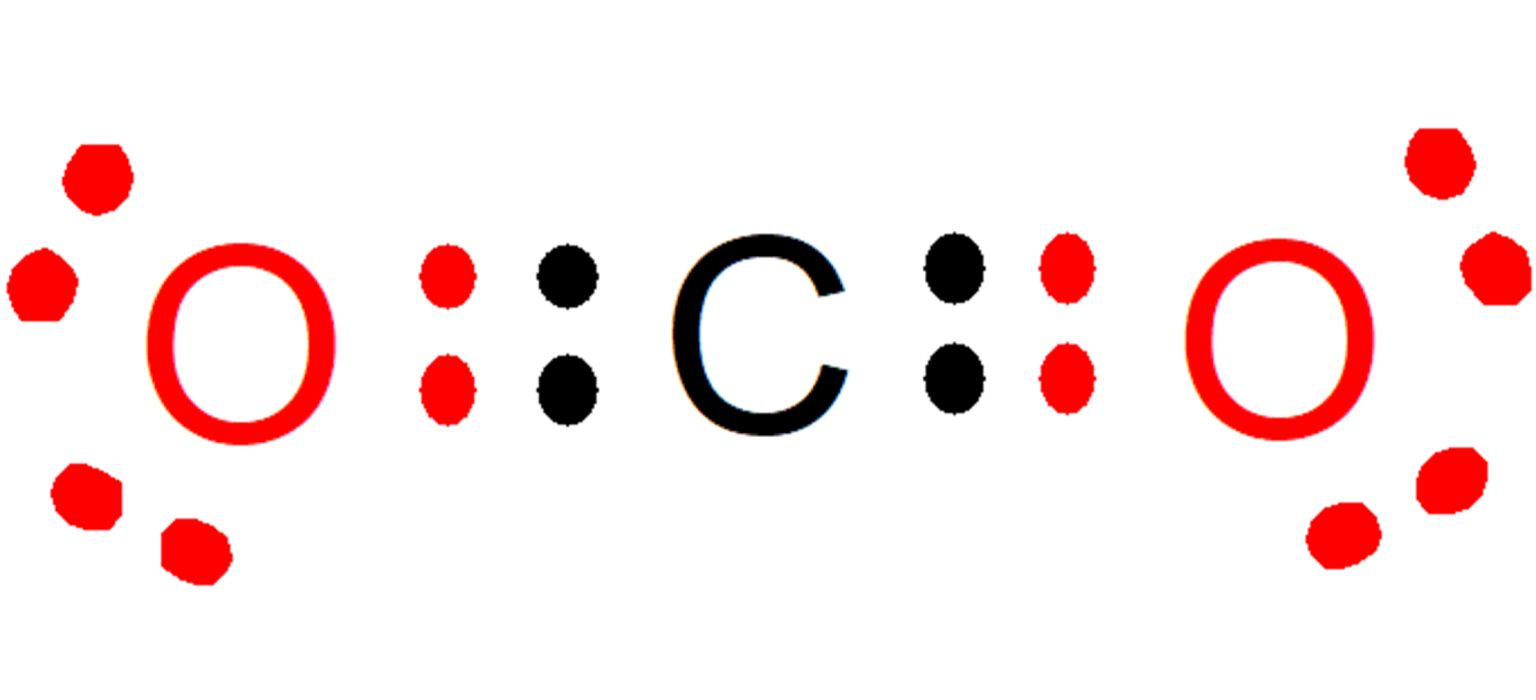
20 Ejemplos de Enlaces Covalentes
Chapter 5.6 Properties of Polar Covalent Bonds Chemistry LibreTexts

Moleculas polares y apolares ejemplos
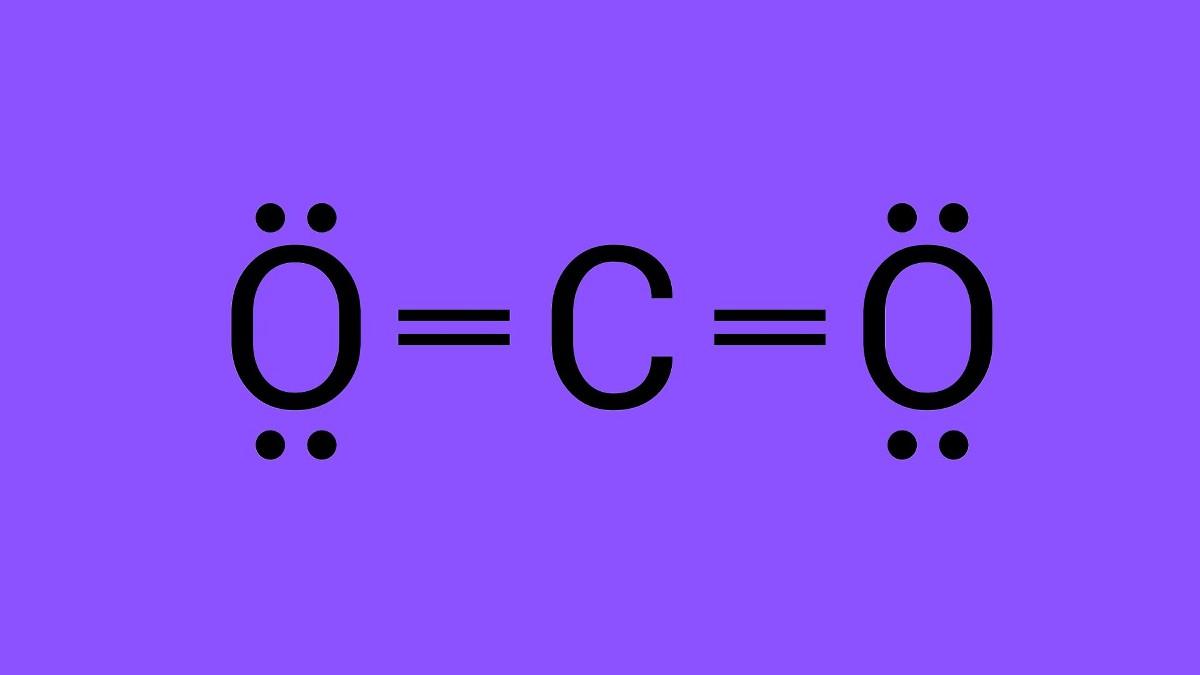
Tipo de enlace del CO2 qué y cómo es, otros elementos similares

QUIMICA

Química Enlaces covalentes polares y no polares, Fuerzas intramoleculares, electrones de

Definición y ejemplos de enlace polar en química Química YuBrain

O que é uma ligação covalente polar? exemplos)

ENLACE COVALENTE POLAR 】Características, ejemplos y más

Enlace covalente polar Definición y ejemplos Curiosoando
Ligações Químicas

Definición y ejemplos de enlace polar en química Química YuBrain
Enlace Químico tipos, ejemplos y características
Definición y ejemplos de enlace polar en química Química YuBrain
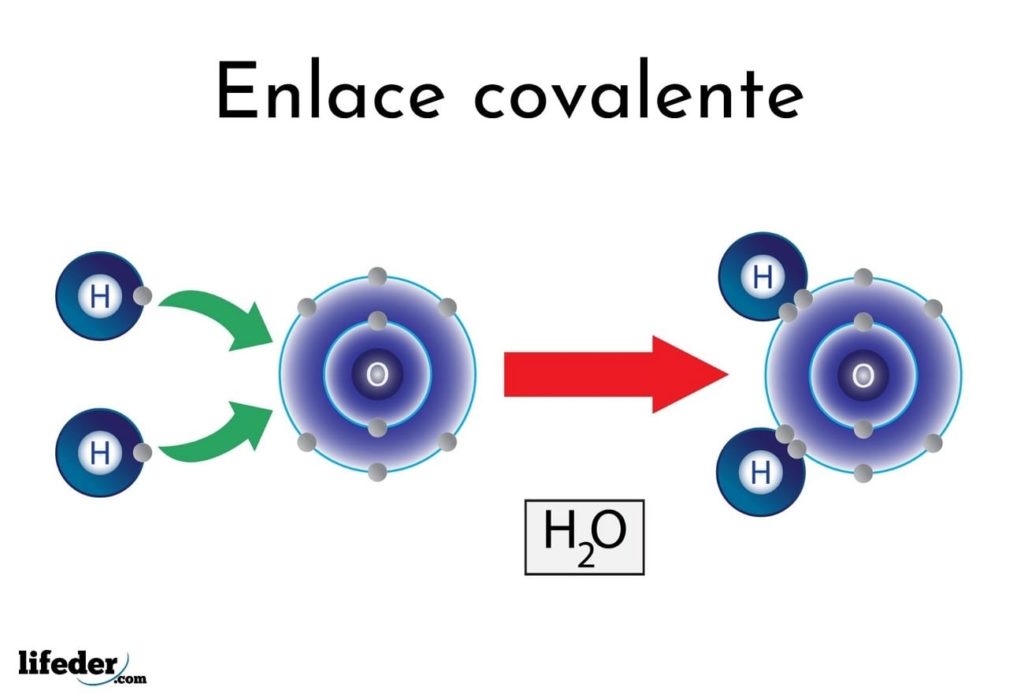
Enlace covalente características, tipos, ejemplos
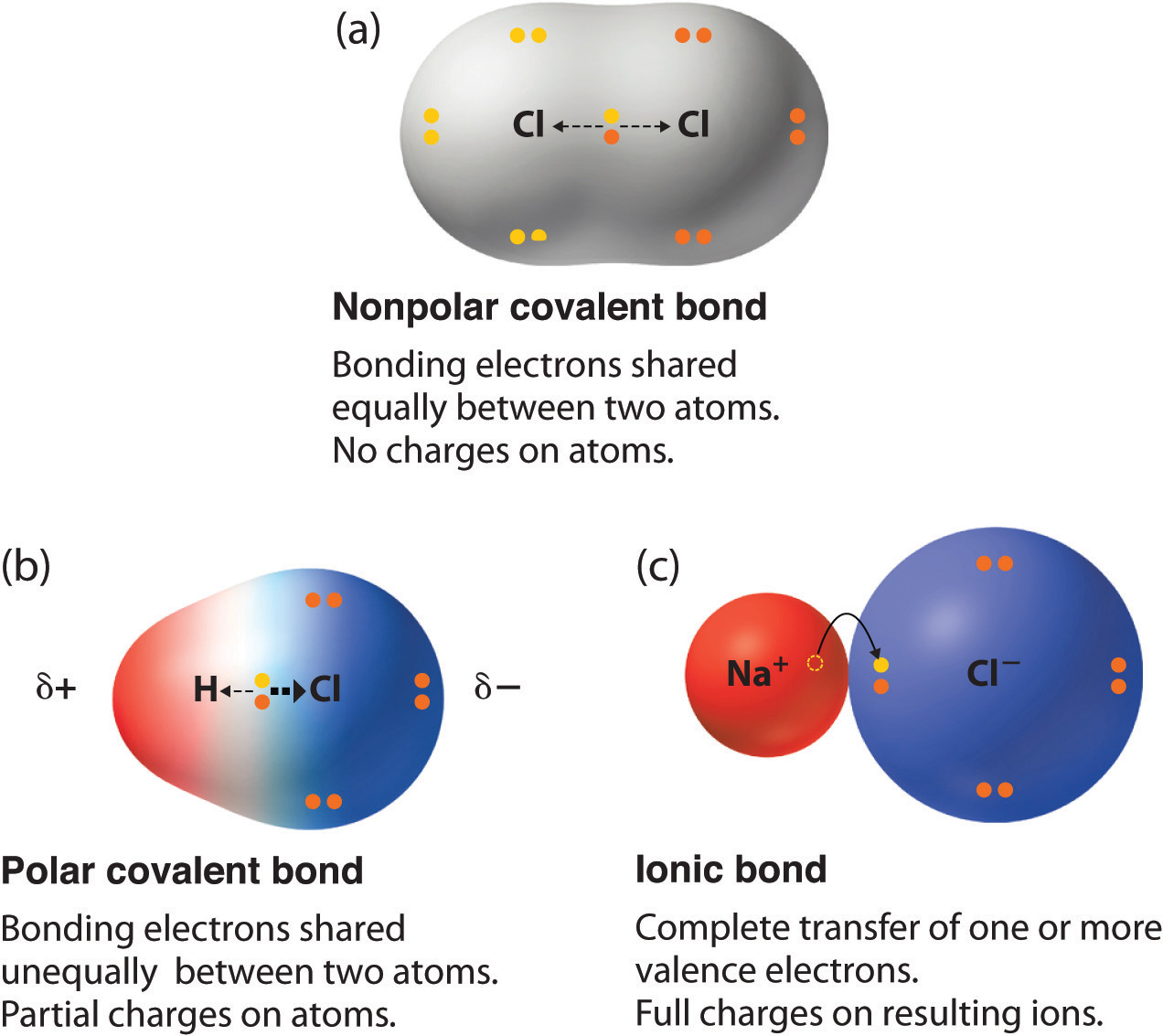
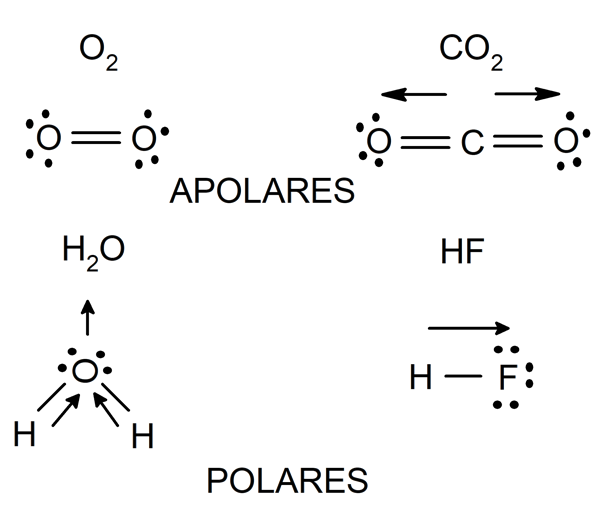
Diferencias en la distribución de cargas en el enlace covalente apolar, el enlace polar y el enlace iónico. La electronegatividad se define como la capacidad de un átomo para atraer los electrones de valencia de otro átomo.. Cuando la diferencia de electronegatividad es muy alta, por encima de 1.7, el átomo más electronegativo le puede quitar los electrones de valencia a otro átomo y.. Cada uno de los enlaces es polar, pero la molécula en su conjunto es no polar. A partir de la estructura de Lewis, y utilizando la teoría VSEPR, determinamos que la molécula de CO 2 es lineal con enlaces polares C=O en lados opuestos del átomo de carbono. Los momentos de enlace se cancelan porque apuntan en direcciones opuestas.